
دمیتری مندلیف هنگام نگارش یک کتاب جامع شیمی دریافت که عناصر را میتوان بر طبق وزن اتمیشان در یک جدول مرتب کرد. در زمان مندلیف هنوز عناصر کشفنشده زیادی وجود داشتند، در نتیجه جدول او ...
دمیتری مندلیف هنگام نگارش کتاب جامع شیمی دریافت عناصر را میتوان طبق وزن اتمیشان در جدولی مرتب کرد. در زمان مندلیف، عناصر کشفنشده زیادی وجود داشتند؛ درنتیجه جدول او جاهای خالی زیادی داشت. اما او دریافت با فرض تناوبی یا تکراری بودن خصوصیات اتمها، میتوان پیشبینیهایی درباره عناصر کشفنشده جدول ارائه داد. کشف اتمهایی که مندلیف پیشبینی کرده بود، نشان داد جدول مندلیف دستهبندی سادهای نیست، بلکه حاوی خصوصیات بنیادی و مهمی درباره ساختار اتمهاست؛ بهاینترتیب، دانشمندان آن را پذیرفتند و از این جدول بهعنوان راهنمای آزمایش استفاده کردند. در این مقاله، قصد داریم زندگینامه دمیتری مندلیف و دستاوردهای او در علم شیمی را مرور کنیم.

دمیتری ایوانوویچ مِندِلیِف (Dmitri Ivanovich Mendeleev) ۸ فوریه ۱۸۳۴ (۱۹ بهمن ۱۲۱۲) در شهر توبولْسْک سیبری به دنیا آمد. او جوانترین فرزند خانوادهای بود که طبق منابع مختلف، از ۱۲ تا ۱۷ فرزند داشت.
پدر دمیتری، «ایوان پاولوویچ مندلیف» (Ivan Pavlovich)، معلم «گیمنازیوم» یا مدرسه پیشدانشگاهی شهر توبولسک بود. ایوان مندلیف در همان سالی که دمیتری به دنیا آمد، نابینا شد و مادر دمیتری، «ماریا دمیترییِوْنا کورنیلِوا مندلیف» (Maria Dmitrievna Kornileva Mendeleev)، برای تأمین هزینههای خانواده کارخانه شیشهای را نزدیک خانهشان خرید و مشغول اداره آن شد.
سال ۱۸۴۷، پدر دمیتری از دنیا رفت و کمی بعد، کارخانه مادرش در آتشسوزی بزرگی نابود شد. باوجوداین، مادر دمیتری او را در ۱۵ سالگی در مؤسسه تربیت معلم سنت پترزبورگ ثبتنام کرد.
مندلیف ۱۸۵۵ از مؤسسه فارغالتحصیل شد و مجوز معلمی را گرفت. او ۱۸۵۹ وارد «دانشگاه هایدِلبِرگ» آلمان شد تا تحصیلات خود را ادامه دهد. او در هایدلبرگ شاگرد «روبرت ویلهلم بونزن» (Robert Wilhelm Bunsen)، شیمیدان آلمانی، شد.

مندلیف سپتامبر ۱۸۶۰ در اولین کنگره بینالمللی شیمی در کارْلْسْروهه آلمان شرکت کرد، جایی که بحثها حول محور وزنهای اتمی شکل گرفته بودند.
دمیتری مندلیف ۱۸۶۱ به سنت پترزبورگ بازگشت اما اولین موقعیت شغلی دانشگاهی خود را سال ۱۸۶۴ به دست آورد که استاد شیمی «مؤسسه فنی» شد. او که نتوانست کتاب مناسبی برای تدریس در کلاسهایش پیدا کند، سال ۱۸۶۸ «اصول شیمی» خود را منتشر کرد.
او در بخشی از این کتاب به ایده مرتبسازی عناصر براساس افزایش وزن اتمی آنها پرداخت. موفقیت او در این روش چنان بود که بهزودی در مقاله «درباره ارتباط خصوصیات با وزنهای اتمی عناصر» (۱۸۶۹) نظریه تناوبی بودن عناصر را بسط داد. مندلیف در این زمان ۳۴ سال داشت. او ۱۸۷۱ نیز نسخهای اصلاحشده از جدول خود منتشر کرد.
مندلیف در ادامه کارهای متفاوتی انجام داد؛ برای مثال، ۱۸۶۷ مسئول غرفه روسیه در نمایشگاه جهانی پاریس بود، تز دکتری خود را با عنوان «اتحاد الکل و آب» نوشت و با آزمایشهای خود صنعت نوشیدنیهای گازدار روسیه را بهبود داد. مندلیف مدتی نیز در صنعت نفت و گاز روسیه مشغول به کار شد.
در ۱۸۹۱، مندلیف مأمور تأسیس نظام گمرکی جدیدی برای عناصر شیمیایی سنگین شد و ۲ سال بعد به ریاست «اداره وزنها و پیمانهها» رسید. از دیگر اقدامات او میتوان به فعالیت در حوزههای کشتیرانی و تجارت دریایی همچنین تولید باروتهای بدون دود اشاره کرد.

دمیتری مندلیف سال ۱۸۶۲ با «فئوزْوا نیکیتیچْنا لشْچِوایا» (Feozva Nikitichna Leshchevaya) ازدواج کرد و آنها صاحب یک پسر و یک دختر شدند. ۱۸۸۲، او خانواده خود را ترک کرد تا با «آنا ایوانووا پوپووا» (Anna Ivanova Popova)، هنرمند جوان، ازدواج کند. دمیتری و آنا ایوانووا صاحب ۲ پسر و ۲ دختر شدند.
مندلیف در شرایطی دوباره ازدواج کرد که فرایند طلاق او از همسر اولش کامل نشده بود؛ به همین دلیل، متهم به دوهمسری شد؛ اتهامی که به عقیده برخی باعث شد سال ۱۹۰۶ که نامزد جایزه نوبل شیمی شده بود، نتواند رأی کافی کسب کند.
در کشور خودش نیز بهعلت عقاید سیاسیاش بهصورت شایستهای از دستاورهای علمی او تقدیر نشد. دمیتری مندلیف یکی از مبلغان حقوق بشر در روسیه و طرفدار اصلاح رژیم تزاری بود. این عقاید سیاسی باعث شدند سال ۱۸۹۰، مندلیف جایگاهش در دانشگاه سنت پترزبورگ را از دست بدهد.
هرچند آنقدر که از جدول تناوبی استقبال شد و بهصورت گسترده به کار گرفته شد، از مندلیف تقدیر نشد. در ۱۸۹۴، او از دانشگاههای کمبریج و آکسفورد مدرک دکتری افتخاری گرفت. انجمن سلطنتی لندن نیز سال ۱۹۰۵ به او «مدال کاپلی» (Copley) اعطا کرد که یکی از معتبرترین جوایز علمی جهان است.
دمیتری مندلیف ۲ فوریه ۱۹۰۷ (۱۲ بهمن ۱۲۸۵) بهعلت نارسایی قلبی درگذشت. دانشجویان او در راهپیمایی تدفین جدول تناوبی را بالای سرش حمل میکردند.

در ۱۶۶۱، رابرت بویل، فیزیکدان انگلیسی-ایرلندی، عنصرها را ذراتی تعریف کرد که نمیتوان آنها را با ابزارهای شیمیایی به موادی سادهتر تجزیه کرد. در ۱۸۰۳، جان دالتون بریتانیایی ایده وزنهای اتمی را برای این عناصر معرفی کرد (که امروز جرمهای اتمی نسبی نامیده میشوند). هیدروژن سبکترین عنصر است و دالتون مقدار یک را به آن داد.
در نیمه اول قرن نوزدهم، شیمیدانان بهتدریج عناصر بیشتری را جدا کردند و مشخص شد برخی گروههای عناصر خصوصیاتی مشابه دارند. مثلاً سدیم و پتاسیم فلزاتی قلیایی هستند که با آب واکنش شدید میدهند و هیدروژن آزاد میکنند. این عناصر چنان شبیه بودند که شیمیدان بریتانیایی «همفری دیوی» (Humphry Davy) وقتی آنها را کشف کرد، نتوانست تمایزی میان آنها قایل شود.
همچنین عناصر هالوژن کلر و برم هر ۲ عاملهای اکسیدکننده سمی و سوزاننده هستند، بااینکه کلر گاز و برم مایع است.
اولین کسی که تلاش کرد عناصر را دستهبندی کند، «یوهان دوبراینر» (Johann Döbereiner)، شیمیدان آلمانی بود. او توانسته بود گروههای سهتایی عناصر با خصوصیات مرتبط کشف کند و دستهبندی خود را بر این مبنا قرار داده بود.
«جان نیولندز» (John Newlands)، شیمیدان بریتانیایی دریافت وقتی عناصر شناختهشده بهترتیب افزایش وزن اتمی مرتب میشوند، عناصر مشابه در هر 8 پله تکرار میشوند. او نتایج خود را در ۱۸۶۴ منتشر کرد و این کشف خود را قانون اُکتاوها یا قانون هشت نامید.
مشکل قانون هشت این بود که الگوی تکرارشونده پس از اتم کلسیم از بین میرفت؛ به همین علت انجمن شیمی بریتانیا که عقیده داشت عناصر باید طبق حروف الفبا مرتب شوند، ایده نیولندز را مسخره و از چاپ مقالههای او اجتناب کرد.
در فرانسه نیز «الکساندر-امیل بگویه دو شانکورتوآ» (Alexandre-Émile Béguyer de Chancourtois) کانیشناس در ۱۸۶۲ الگویی مشابه پیدا کرده بود اما توجه کمتری به آن شد.

همزمان دمیتری مندلیف که نگارش «اصول شیمی» را آغاز کرده بود، با این مسئله روبهرو بود. تا آن زمان، ۵۶ عنصر کشف شده بودند و تقریباً هر سال یک عنصر جدید کشف میشد.
مندلیف معتقد بود این عناصر باید الگویی داشته باشند؛ او ۵۶ کارت بازی تهیه کرد و روی هرکدام نام و خصوصیات یک عنصر را نوشت.
میگویند مندلیف پیش از آنکه در زمستان ۱۸۶۸ عازم سفر شود، کارتهای خود را مانند کارتهای بازی روی میز چیده بود. درشکهچی که برای بردن چمدانها وارد اتاق شد، مندلیف او را بیرون کرد و مشغول حل معما شد تا درنهایت توانست تمام ۵۶ کارت را به شیوهای رضایتبخش در گروههای عمودی بچیند.
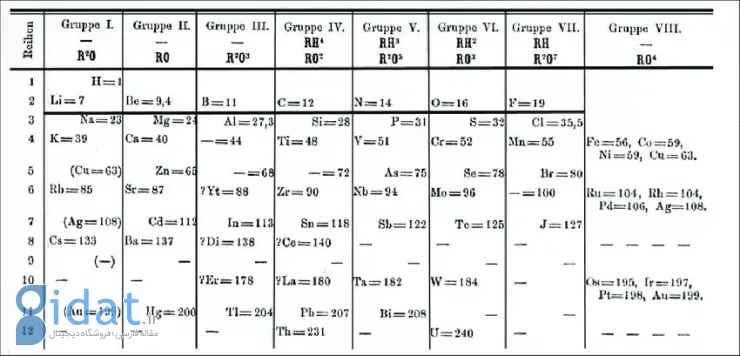
سال ۱۸۶۹، مندلیف نتایج کارش را در مقالهای به انجمن شیمی روسیه ارائه کرد. او توضیح داد عناصر با خصوصیات مشابه یا وزنهای اتمی نزدیک دارند (مانند پتاسیم، ایریدیم و اُسمیم) یا وزن اتمیشان منظم افزایش مییابد (مانند پتاسیم، روبیدیوم و سزیم). او همچنین توضیح داد گروهبندی عناصر طبق وزنهای اتمیشان با ظرفیت شیمیایی آنها (تعداد پیوندهایی که یک اتم میتواند با اتم دیگر شکل دهد) منطبق است.

مندلیف در مقاله خود ادعای بزرگی کرده بود: «ما باید منتظر کشف عناصر ناشناخته بسیاری باشیم؛ برای مثال، 2 عنصر، شبیه آلومینیم و سیلیکن، که وزن اتمیشان بین ۶۵ و ۷۵ خواهد بود.»
مرتبسازی مندلیف بهبودهای مهمی نسبت به اکتاوهای نیولندز داشت. نیولندز کرومیم را زیر بور و آلومینیم قرار داده بود که چندان معقول نیست. در عوض، ادعا کرد باید در آن خانه جدول عنصر کشفنشدهای وجود داشته باشد و پیشبینی کرد عنصری با وزن اتمی حدوداً ۶۸ پیدا خواهد شد. این عنصر یک اکسید با فرمول شیمیایی M2O3 تشکیل میداد و «M» نماد عنصر ناشناخته بود.
مندلیف 2 عنصر دیگر را نیز برای جاهای خالی دیگر پیشبینی کرد: یکی با وزن اتمی حدوداً ۴۵ و اکسید M2O3 و دیگری با وزن اتمی ۷۲ و اکسید MO2.
منتقدان مشکوک بودند اما مندلیف ادعاهایی بسیار جزئی داشت. یکی از بهترین راهها برای تأیید نظریه در علم شیمی پیشبینیهایی است که درست از آب درمیآیند. در این مورد، عنصر گالیم (با وزن اتمی ۷۰ و اکسید Ga2O3) در ۱۸۷۵ کشف شد؛ اسکاندیم (وزن ۴۵ و اکسید Sc2O3) در ۱۸۷۹ و ژرمانیم (وزن ۷۳ و اکسید GeO2) نیز در ۱۸۸۶ کشف شدند. این کشفها 2 دهه بعد از مسخره شدن نیولندز مندلیف را مشهور کردند.

مندلیف اشتباهاتی نیز داشت. او در مقاله خود ادعا کرد وزن اتمی تلوریم اشتباه اندازهگیری شده است؛ این عدد باید بین ۱۲۳ و ۱۲۶ میبود؛ زیرا وزن اتمی ید ۱۲۷ است و واضح است ید، مطابق خصوصیاتش، باید در جدول بعد از تلوریم بیاید. او اشتباه میکرد؛ وزن اتمی نسبی تلوریم در حقیقت ۱۲۷.۶ و از وزن اتمی ید بزرگتر است.
ناهنجاری مشابهی بین پتاسیم (وزن ۳۹) و آرگون (وزن ۴۰) رخ میدهد؛ زیرا آرگون بهوضوح باید پیش از پتاسیم بیاید. البته مندلیف سال ۱۸۶۹ از این مشکلات آگاه نبود؛ زیرا آرگون سال ۱۸۹۴ کشف شد. آرگون گازی نجیب بیبو و بیرنگ است که بسیار بهندرت با عناصر دیگر واکنش میدهد (آرگون بهرغم نجیب بودن، در شرایطی خاص، واکنشپذیر میشود).
هیچکدام از گازهای نجیب که شناسایی آنها دشوار است، آن زمان کشف نشده بودند؛ مندلیف در جدول خود جایی برای آنها در نظر نگرفته بود. با کشف آرگون، حفرههای جدیدی در جدول پدیدار شدند. تا سال ۱۸۹۸، «ویلیام رمزی» (William Ramsay)، شیمیدان اسکاتلندی، عناصر نجیب هلیم، نئون، کریپتون و زنون را نیز جدا کرد.
درنتیجه، مندلیف سال ۱۹۰۲ گازهای نجیب را با عنوان «گروه ۱۸» وارد جدول خود کرد و این نسخه از جدول همانی است که جدولهای عناصر امروزی بر پایه آن شکل گرفتهاند.
مسئله وزنهای اتمی «اشتباه» را «هنری موزلی» (Henry Moseley) ۱۹۱۳ حل کرد، زمانی که با استفاده از اشعه X تعداد پروتونهای هسته هر اتم عنصر را تعیین کرد. پس از کار او، دانشمندان تعداد پروتونها را عدد اتمی عناصر نامیدند و حالا این عدد است که موقعیت اتمها را در جدول تناوبی تعیین میکند.
علت اینکه وزنهای اتمی تقریب خوبی به مندلیف میدادند، این است که در عناصر سبکتر، وزن اتمی تقریباً دوبرابر عدد اتمی است اما این نسبت در عنصرهای سنگینتر از بین میرود.
در این مقاله، زندگینامه و دستاوردهای دمیتری مندلیف را مرور کردیم. جدول تناوبی عنصرها سیستم طبقهبندی بسیار ظریف و تمیزی به نظر میرسد اما در واقع اهمیت آن در علوم شیمی و فیزیک بسیار بیشتر است.
این جدول به دانشمندان امکان تا خصوصیات عنصری را پیشبینی کنند و تغییراتی فرایندهای شیمیایی ایجاد کنند؛ برای مثال، اگر واکنش خاصی با عنصر کروم اتفاق نمیافتد، شاید با مولیبدن، عنصر پایین کروم در جدول، رخ دهد.
نقش این جدول در کشف ساختار اتم نیز حیاتی بود. چرا خصوصیات اتمها طبق این الگوها تکرار میشوند؟ چرا گروه ۱۸ چنین واکنشناپذیر است اما ۲ گروه کنارش از همه واکنشپذیرترند؟ چنین پرسشهایی مستقیم به کشف ساختار اتم منجر شدند.
مندلیف تا حدی خوششانس بود که این جدول به نام او ثبت شد. او نهفقط ایدههای خود را پس از بگویه و نیولندز منتشر کرد، بلکه از «لوتار مایر» (Lothar Meyer)، شیمیدان آلمانی که نمودار وزن اتمی در مقابل حجم اتمی را رسم کرد تا ارتباط تناوبی عناصر را نشان دهد، نیز عقبتر بود. مثل بسیاری از موارد دیگر در تاریخ علم، موعد یک کشف علمی خاص رسیده بود و چند دانشمند همزمان، بدون اطلاع از کار یکدیگر، به این کشف نزدیک شدند.

مندلیف شیمیدان و مخترع اهل روس بود و در زمینههای مختلفی فعالیت میکرد اما بزرگترین دستاورد او که نامش را جاودان کرد، کشف قانون تناوبی عنصرها و تهیه جدول تناوبی عناصر بود. این جدول طبقهبندی ساده نیست. دانشمندان با استفاده از جدول تناوبی خواص عنصرها را پیشبینی میکنند و فرایندهای شیمیایی جدیدی طراحی میکنند. این جدول به راهنمایی علمی برای شیمیدانان و فیزیکدانان تبدیل شد. در این مقاله، زندگی این شیمیدان بزرگ را مرور کردیم.
زمانی که مندلیف اولین نسخه جدول خود را تهیه کرد، فقط ۵۶ عنصر کشف شده بودند و او مجبور شد جای تعدادی از عنصرها را خالی بگذارد. جدول اولیه او ایراداتی نیز داشت که در نسخههای بعدی برطرف شدند. کشف گازهای نجیب اواخر قرن نوزدهم باعث شد مندلیف گروه این گازها را به جدول خود اضافه کند که این نسخه پایه جدول تناوبی امروزی است.
مندلیفیم (Mendelevium) با حروف اختصاری Md و عدد اتمی ۱۰۱ یک عنصر فرا-اورانیمی رادیواکتیو فلزی است که نام آن را به پاس خدمات مندلیف به علم شیمی انتخاب کردهاند.
پاسخ ها